生长激素到底能够增加肌纤维数量吗?
媒介
1、本文为本人原创,未经受权不得转载,侵权必究
2、本文8500多字,介绍了生长激素、IGF-1的感化机理,然后再切磋了它们与肌纤维数之间的关系
3、本文关于有生物根底的人来说是外相,但对毫无根底的人来说,可能会是痛苦的阅读履历。若是觉得难,间接看要点归纳综合就行了
4、关于没有响应根底的读者,若是希望读懂,万万不要跳着读,万万不要往下拉,一字一句的看。跳和拉只会让人越来越懵
5、抬杠和非友善言论会被删留言、拉黑
要点归纳综合1、从健身喜好者的增肌视角而言,总体上,生长激素自己阐扬的感化相对次要(不是没有);
2、生长激素的感化,次要是通过它的下流激素IGF-1(类胰岛生长因子-1)产生的;
3、IGF-1的生成,次要靠生长激素感化于肝(但生长激素也能感化于其他器官如肌肉来排泄、还有许多器官本身也能排泄IGF-1);
4、IGF-1能形成增肌,次要是通过基因(上调肌内卵白的基因表达等);
5、关于【利用外源性生长激素能否增加肌纤维数】而言,目前不单缺乏撑持证据,还存在一些中等强度的反对证据。因而我小我不撑持该概念。
6、关于【训练能否能增加肌纤维数】,本文因为篇幅不敷,没有讨论。但是,总体上更多的证据认为不克不及。固然有一些争议,但是那不重要。
因为,重要的是,即使能增加,它关于增肌的奉献来说也是微乎其微的。那一点,是支流观点,包罗运动心理学上教材也是间接下结论的。
一、生长激素生长激素,Growth hormone,缩写GH。
寡所周知,GH是一种由垂体前叶排泄的肽类激素(1,2)。
固然它由垂体排泄,但由下丘脑调理。下丘脑可上调、下调GH的排泄(3,4)。
当下丘脑释放释放“生长激素释放因子”(GHSs)时,上调垂体对GH的排泄;当它释放释放“生长按捺素”(GHRH)时,下调垂体对GH的排泄。(为了赐顾帮衬没根底的健身喜好者,略烦琐,见谅)
也就是说,对排泄GH那件事而言,下丘脑是垂体的“上级”。
健身健美喜好者们都晓得,生长激素的次要感化是增肌减脂(还有对骨骺未闭合的儿童/青年能够长高),但其感化远远不只如斯。张等人2020年的研究发现,患有生长激素缺乏症的儿童,其大脑功用和构造均呈现异常(16)。
事实上,GH的功用多、用处广。除了促进细胞生长、团结和再生(6,7)外,在维持新陈代谢/免疫系统功用、调理生殖系统和心血管系统、神经系统(8,9)等个个范畴都有感化。
人体几乎所有细胞上都有生长激素受体(13)。
二、生长激素的生效路子路子一:GH间接感化于身体各类细胞(77)。例如肌细胞、神经细胞、内脏等。
路子二:GH感化于肝(77)。
那两条生效路子,第一种是相对次要的,第二种是相对次要的(2,4,5)。
我们都传闻过 “健美运发动利用外源性GH来增肌” 那件事。仿佛认为GH就能增肌,其实那么说十分禁绝确,以至能够说是错的。
GH的效能,次要靠的是IGF-1(类胰岛生长因子-1)(5)。
IGF-1是骨骼肌发育(儿童/青少年)、增粗(成人)、再生(创伤)所的重要生物因子(76,77,78,79,80)。
例如说,若是GH是大老板,那IGF-1就是他的一个司理。大大都详细的工做,老板不会亲身做,只需要下达指令给部分司理。
当然,少少数工做老板是要亲身去的,好比照顾咖啡零食慰问彻夜加班的员工。
所以,考虑GH的增肌效果,我们的目光次要落在IGF-1上,而不是GH自己。
三、既然生长激素的效果很大水平是通过IGF-1来实现,那么IGF-1从哪来的?GH次要感化于肝,然后由肝产生IGF-1,IGF-1再感化于肌细胞,实现增肌(10,11)。所以,IGF-1也被称为GH的下流激素。
那是简要归纳综合。不外各人能够略微多领会一点。
我们都晓得,激素需要与受体连系才气生效,GH当然也是(68)。
GH的受体叫GHR(Growth Hormone Receptor)。
GHR大量存在于肝细胞上(当然,全身其他细胞也有),它是一种卵白,一种跨膜卵白。
跨什么膜?当然是细胞膜。
为什么要跨膜?因为进不去。
那GH进不去,莫非其他激素就能进去?
当然,类固醇类(如睾酮/皮量醇/雌激素等)就能够。
有印象的读者应该还记得我以前在连载讲过的根底常识,激素分为类固醇激素和非类固醇激素。
类固醇激素能够穿细致胞膜,进入细胞内,最初落到基因上阐扬感化。而非类固醇激素,则不克不及进入细胞,只能在细胞膜上,与受体连系。
就像有些小区,骑手能够把外卖间接送到住户门口(像类固醇激素),有些就只能放在门卫那(像非类固醇激素)。
GH属于非类固醇激素,不克不及进入细胞,只能在细胞膜上与受体(GHR)连系。但是如许还不敷啊,还没生效呢。所以,后的工作才是关键。
那些事务的名称各人可能不熟悉,但我们要晓得生长激素的感化原理(IGF-1怎么来的),就必需领会下面的根底信息。
上图中,黑色竖立的粗线,就是GHR,它镶嵌在细胞膜上。
GH在细胞外表与GHR连系,引发一种名为JAK2的卵白磷酸化(114),再激活多条细胞内的分子信号通路(13)。
此中,中间的那条红色通路的激活(STAT5),最引发致IGF-1基因的转录增加(13)。
我们的IGF-1,很大一部门就是那么来的。
当然,若是JAK2和STAT5通路受损,就会呈现“有生长激素,但是IGF-1不敷”的情况,那也被称为 “生长激素抵御”(113)。
IGF-1的来源,除了GH-肝,还有部门是来自全身其他各类细胞排泄的。例若有研究发现,运动自己也会招致一些细胞排泄IGF-1(16,17)。
不外,GH不但是能够感化于肝来生成IGF-1,感化于肌肉也能生成一些(112,115,116)。
那就是GH次要感化的简单梳理:与GHR连系后,激活多条细胞信号通路、最末招致IGF-1的基因表达上调、IGF-1在肝的合成增加。
所以,我们也清晰了,类固醇/非类固醇激素的最末落脚点都是基因。
其实,不单单是GH和外源性激素,就连训练也是一样的,并非间接生效,而是通过改动基因的表达来生效(造造更多的肌原卵白等)。
很明显,基因是第一位的,是绕不外的,激素和训练紧随其后。
体育界发现,药物利用后,有些运发动前进很大,有些前进甚微,也就是我们之前在连载说过的高反响者、低反响者(还有无反响者)。
那申明,“利用外源性激素之后的效果好坏”,次要是基因决定的。
健美喜好者经常会说:不可的人,给他一吨药他也不可。
为什么呢?原因次要是基(yun)因(qi)方面的事。
四、IGF-1与增肌寡所周知,肌纤维是有丝团结后的细胞,其大小取决于骨骼肌内的新卵白合成和旧卵白合成之间的平衡。在一般情况下,卵白量的合成和合成速度是平衡的,肌纤维的大小连结稳定。
在疾病、营养不良、停训、睡眠不敷、某些激素程度紊乱、工做/精神压力、严重/焦虑/过度用脑(好比我)等情形下,肌纤维卵白合成速度加快,卵白量合成速度降低,招致肌肉体积缩小、力量下降、易委靡。
大量证据显示,IGF-1能够调理卵白量合成和降解路子。骨骼肌中IGF-1信号的改动,对肌纤维的大小和功用有很大的影响。它是调理骨骼肌合成/合成代谢、决定肌肉大小的关键因子(17,76,77,78,79,80)。
那IGF-1详细是若何生效的?能够归结为一句话:“通过某些分子信号通路,影响基因表达”(42,43,77)。
如许说或许有些模糊,详细影响了什么工具的基因表达?
当然是构成我们肌纤维的那些卵白量的基因表达了。
不熟悉生物的同窗可能会有疑问,卵白量还有基因吗?
就构成我们身体(肌纤维)的卵白量来说,当然有。就在肌纤维里面。
肌纤维就是肌细胞,也是有细胞核的。
并且,一般的细胞一个核,而肌细胞有多个细胞核。
IGF-1就是影响了我们的肌纤维里面的卵白量的DNA(图中绿圈,细胞核里面的)来实现增肌。
然后我们继续。
各人都晓得卵白量有良多品种,它们一般是由多个氨基酸构成的长链大分子。
我们吃下去的卵白量,并非间接就到了肌肉里面,而是被拆解为各类氨基酸等,再由身体把它们 “组拆” 成我们肌肉所需、特定分子机构的卵白。
身体若何组拆?当然是靠设想图(DNA)。
粗略说,IGF-1影响了肌肉里面卵白量的DNA,那么造出来的肌卵白就更多。
所以,关于 “我们若何把吃下去的卵白量合称为我们本身的肌纤维” 那件事来说,大致有点像:
我们把房子拆了(好比吃的鸡胸肉、喝的卵白粉),拆分为小的砖头(氨基酸),然后我们再根据设想图(我的肌内卵白的基因),来修建新的建筑———那就是我们的肌纤维(肌原纤维、粗/细肌丝)。
因而,我们前面说的 “IGF-1通过一些分子信号通路,来上调了基因的表达”,意思就是,就是上调了肌肉内的各类卵白的表达。
详细什么卵白呢?好比肌源卵白(77)。它是构成肌纤维、肌原纤维的重要卵白之一。
下面那张图就是IGF-1的感化原理示企图。不要怕,其实不复杂。
图中,蓝色的像墙一样的工具是细胞膜。
各人会看到细胞膜上有黄色的、穿细致胞膜的 “IGF-1R”,那就是IGF-1的受体(74)。
IGF-1也不是类固醇激素,不克不及进入细胞内。它在细胞膜外表与受体连系后,引发后续系列细胞事务:IRS-1和PI3K被激活(69,70,71,72,73),接着AKT被激活(44)。
所以,那一条细胞信号通路也叫做IGF-1/PI3K/AKT通路。
第一次见?不妨,以后你会很熟悉它的。
那条细胞信号通路关于肌肥大极为重要(20,21,24,25),以至于有些研究者认为它是必不成少的(26)。
在AKT路子的下流,又产生了几个分收通路。
第一个分收是mTOR(哺乳动物雷帕霉素靶卵白)及其下流因子(45,46,48)。(下图的红圈和线)
在该信号通路上,IGF-1通过AKT,激活mTOR,最末(47)加强了2个下流因子:S6和eIF4E(20,21)。
S6是“核糖体S6卵白激酶”的缩写,次要感化包罗基因转录、调理细胞周期、细胞代谢等;
eIF4E是Eukaryotic Initiation Factor4-E的缩写,中文名实核细胞起始因子4E,又叫帽卵白,它能与另一种卵白EIF4G(实核细胞起始因子4G)彼此感化,在DNA的翻译、表达中起重要感化(22,23,49)。
也就是说,详细的路子是IGF-1 → PI3K → AKT → mTOR → S6 & eIF4E(图上画的红圈)。
S6和eIF4E是分子信号末端的因子,他们间接感化于肌源卵白(还有其他卵白)的基因,上调其表达,招致肌内卵白合成增加,从而增肌(22,23,49)。
第二个分收是GSK3β(糖原合成酶激酶3β,下图黄色的圈和线)。
在那条途径上,AKT通过将GSK3β磷酸化的形式来按捺它(50)。
然后呢?就激活2种GSK3β下流因子的活性(eIF2B和β-catenin)(27,28)。再然后呢?那两种下流因子若何招致增肌?当然,仍是通过感化于基因。
eIF2B是Eukaryotic Initiation Factor2-B的缩写,中文名实核细胞起始因子2B,与前面的elF4E类似,它在mRNA的翻译中,阐扬了重要的感化(36,49)。
β-catenin是一种调理卵白,在必然前提下进入细胞核激活转录活动(35)。
心细的同窗可能会发现,为什么按捺上游因子(GSK3β)的同时还能激活2种下流因子呢(eIF2B和β-catenin)?
可能因为它们具有相反的功用。
已证,GSK3β对肌卵白合成起按捺感化(51,52,53,54,55),它的2种下流因子对肌肉合成起正面上调感化(49)。
我们做个梳理。GH是公司董事长,IGF-1是公司总司理,AKT是部分司理。所谓IGF-1/PI3K/AKT信号通路,就有点像是指导层。
AKT手下有多个科长,我们已经介绍了2个次要的。
第一个科长叫mTOR,他手下有2个员工(eIF4E和S6)。
第二个科长叫GSK3β,也有2个员工(eIF2B和β-catenin)
第一个科室全员都是OK的。
第二个科室的科长老是不干事(GSK3β),但2个员工是积极干事的。
于是副司理(AKT)通过打压那个不干事的科长(GSK3β),来激发该科室内2个员工(eIF2B和β-catenin)的工做积极性。
现有的科学证据发现,上述通路对维骨骼肌体积极为重要。现已证明,在各类肌萎缩的模子中,那些通路都遭到了负面影响(30,31,32,33)。
出格要留意的是,整个IGF-1分子信号通路的底层因子(那4个员工:eIF4E、S6、eIF2B、β-catenin)都是通过基因环节造造 “增肌效果” 的。
五、IGF-1的另一种增肌体例我们适才讲了2个科长和他们的科室(mTOR和GSK3β),那2条信号途径都是“增肌”途径。
其实IGF-1的“增肌”体例,还有另一类:按捺那些会招致肌肉萎缩的细胞信号。那就有点像,指导层不但会鼓励消费/营业部分产生“收入”,还要管控财政,来削减“收入”,严酷审批预算、控造报销等。
可能有些同窗不解,身体还有细胞信号会招致肌肉萎缩的?
当然有,并且良多。例如,各人都晓得的用进废退。肌肉不消了,就要逐步减小、萎缩。
为什么会萎缩呢?因为肌肉本身会排泄一些因子,如肿瘤坏死因子-TNFα(75),让肌纤维内的卵白合成多于合成,肌纤维尺寸就会缩小。
做为证明,David等人的研究陈述说,IGF-1/PI3K/AKT路子不单能激活一些“合成代谢信号通路”(37,38)(之前说过的科室一、二),也能按捺一些合成代谢信号通路(19),例如TNF途径。
那就像指导要考虑两件事:增加营业收入、控造运营成本。
接下来我们简单领会下TNF途径。它是肿瘤坏死因子的缩写。
望文生义,它具有杀伤、坏死、萎缩、按捺等感化。它能按捺肿瘤细胞生长,毁坏其血管招致其灭亡,也能按捺一般细胞的“增肌”。
说个题外话,我们打例如说,若是说你的肌肉是花园,那么癌细胞就像是杂草。你给花园施肥,花会生长,杂草也会生长。你喷洒毒药,杂草死了,花也不可了。
许多药商会说:XXX激素是你本身就有的,是天然的,所以无害,安心用,安心买!
那就叫谋财害命。
强力合成代谢的激素,是2A级的致癌物。
那意味着在动物尝试上,就是明白致癌。
在人类身上为什么不确定?因为人道关系:你不成能对几万、几十万人做那种尝试,让他们表露在强致癌物下,患上癌症,来获得你想要的大数据。
但是,药商不会告诉你,许多强力的合成代谢因子、激素,也被医学上的肿瘤研究视为癌症开展的关键因素之一。
例如,去氢睾酮,它的增肌增力效果,是通俗睾酮的好几倍,它致癌性也成比例增加。
记住,“科技” 是致癌物。
反过来,许多按捺肌肉生长的物品,如二甲/阿司匹林,也具有必然的抗癌感化。回到本文,TNF的做为一个按捺肌肉生长的因子,它的详细感化由一系列下流的分子信号通路来施行。
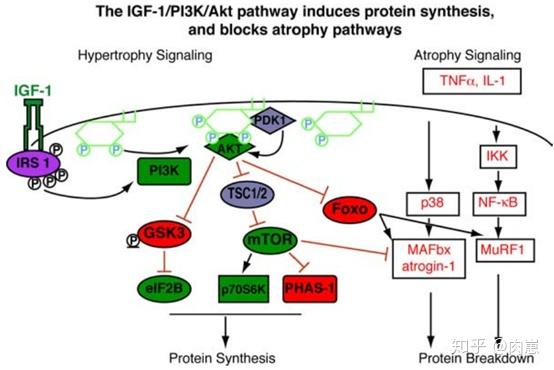
如图所示,TNFα后面有个诱导骨骼肌萎缩的分子信号通路,它的2个下流因子(MAFbx和MuRF1)感化是促进骨骼肌萎缩、卵白量合成(56,58,59,60)。
有研究指出,MuRF1能引起肌纤维内的粗肌丝上的肌球卵白降解,从而引发肌肉萎缩(62)。
那那些工具跟我们要说的GH、IGF-1有啥关系呢?
IGF-1的下流因子AKT,能够削减MAFbx和MuRF1的数量。
MAFbx和MuRF1是促进骨骼肌萎缩的,所以它们少了,你的肌肉就会大一点。
那AKT为何能削减MAFbx和MuRF1的数量呢?
因为AKT能通过按捺FOXO基因(有趣的是,那是长命基因),从而按捺MAFbx和MuRF1的转录上调,如许,那两个家伙就少了。
所以,我们适才看了增肌与致癌的关系,在那里也看到了长命与肌肉萎缩的一个单薄关系(按捺了长命基因FOXO也就按捺了MAFbx和MuRF1的转录程度)。
那方面,我们能够回忆起一些新闻,说一些大剂量利用激素然后得了癌症的不幸运发动的例子。
那么,AKT而使MAFbx和MuRF1的数量削减了,削减了骨骼肌合成、萎缩,也就变相增肌了。做为证据,研究发现IGF-1基因突变型小鼠的肌肉程度明显高于对照组,提醒可能是IGF-1/PI3K/AKT途径对TNF等合成代谢通路的按捺(39,40)。
除了我们上面介绍的TNF,还有各人耳熟能详的肌肉生长按捺素(Myostatin),它也有点像IGF-1的 “对头”。
肌肉生长按捺素(Myostatin)是转化生长因子-β(TGF-β)家族成员之一,次要由骨骼肌排泄,感化是下调骨骼肌体积(63)。
研究已经确定了肌生长抑素和IGF-1之间,存在彼此拮抗关系。
一系列研究发现,肌肉生长抑素会障碍IGF-1/PI3K/AKT路子,招致卵白量合成削减,招致细胞大小缩小(64,65,66)。
反过来,在缺乏肌生长抑素的小鼠中,IGF-1的下流因子如Akt和S6,总量增加(64,67)。
所以,那就部门解释了为什么有些人的肌肉,生成就出格大。那可能仅仅是因为他的肌肉生长按捺素比力少(当然,还有其他良多可能)。
肌肉生长按捺素是怎么来的呢?它有本身的上游基因。若是说基因就是设想图,那么身体就按照那设想图,造出肌肉生长按捺从来。
若是该基因表达欠好,那么某人的肌肉生长按捺素就少,他就可能成为形体运发动、肌肉网红什么的。
各人要大白,那是基(yun)因(qi)的问题,不是训练的问题。
回到主题,医学发现,在癌症、心脏病、HIV和衰老中,发现肌肉生长抑素的数量上调。此外,大量**肌抑素会引起啮齿类动物的一些恶性疾病。
IGF-1能够匹敌肌肉生长按捺素。有研究发现,IGF-1**,能够在必然水平阻断肌肉生长抑素招致的Akt的下调和肌纤维曲径削减(66)。
好了,我们在那里做个小结:
总的来说,IGF-1/PI3K/AKT同时路子影响我们体内多个“增肌”“减肌”的因子,进而通过影响基因表达的体例(42,43),调理骨骼肌细胞内的卵白合成、合成的比值,从而决定肌肉大小(57)。 那就是GH和IGF-1增肌的次要原理。 六、为什么有网友会相信“GH能增加肌纤维数?”因为他们看了些药商文章。

 明眼人会发现,那些所谓的收集文章,都是没有任何证据、文献、数据撑持的。
请记住:没有证据的文章的就是口嗨。
七、谁来证明?
明眼人会发现,那些所谓的收集文章,都是没有任何证据、文献、数据撑持的。
请记住:没有证据的文章的就是口嗨。
七、谁来证明?
当然是谁主张谁举证了:应该由药商来证明。
我们在切磋的时候,碰到一位令人啼笑皆非的网友,他说:
你认为GH不克不及增加肌纤维数?那就应该由你来反证。
那几乎就是神逻辑。十分可怕,连常识都没有。
一般人都晓得,“谁主张,谁举证” 是保障人类社会可以运行的根本的逻辑。
若是不遵照那种逻辑,那个世界就要乱套了。
好比说,A主张B欠了他钱,就应该A举证,而不是B来反证本身没欠A钱。
若是根据上面那位网友的逻辑,对话就会酿成如许:
A:你欠我一个亿
B:证据呢,你有欠条吗?
A:欠条你可能烧了,请你证明你没有欠我一个亿
B:那我银行存款、微信付出宝也没一个亿啊
A:你可能兑换成钻石然后藏在某海岛/山洞了。
除非你证明你没把价值一个亿的钻石藏在全世界任何一个角落,不然,你就欠我一个亿。
B:@!%&@!~~(#&@(*##
看起来是胡搅蛮缠对吧?
没错,就是那种逻辑。
关于逻辑问题,我们还能够从法理来做参考。
因为,法理逻辑是最严谨的,法庭判决是个开不得打趣的工作。
任何一个律师/法官/法令从业者都晓得,在支流的法令系统中,都是控方举证。控方需要举出充实的证据证明被告的立功事实清晰明白,不存在任何疑点;没有一个一般的**/法官会要求被告去自证无功。
所以,此事,从逻辑上,应当药商举证。
不举证就是口嗨,就是意淫,就是捏造,就是虚构。
人类之所以可以前进,科学界的话语权只要一种:讲证据(足够强度的证据)。
详细来说,就是paper,也就是各人说的“干货”。
八、现有证据指向,GH/IGF-1对肌纤维的感化次要是“增粗”,而非“增加”。凡事讲证据。
Bohni等人(81)对果蝇的研究表白,IGF-1的下流因子:AKT,它其实是一条控造细胞大小的通路。
Leevers等人陈述说,PI3K、mTOR、p70S6K等的负面基因扰动,也招致细胞大小缩小(82,83,84)。
Ohanna等人发现(85),p70S6激酶(IGF-1的下流因子)的激活,关于维持肌肉纤维的大小是需要的,因为,一旦敲除骨骼肌细胞的p70S6基因,骨骼肌尺寸就会变小。
LAI等人的研究造造了一种AKT突变型小鼠(41),其AKT高度激活,其单个骨骼肌肌纤维的横截面积增加了2倍以上。
留意,上面说的那些AKT、PI3K、mTOR、p70S6K等,都是IGF-1的下流因子。
其实,除了那些以外,我们在前面已经列举了大量证据都指向:IGF-1及其下流分子信号通路次要通过上调肌卵白DNA表达(如增加mRNA数)来增肌。
也就是说,IGF-1路子,自己就是“增加尺寸、而非数量”的通路。
(2,4,5,6,10,11,17,19,20,21,23,24,25,26,27,28,29,36,39,40,42,43,44,45,46,47,48,49,51,52,53,54,55,56,57,66,69,70,71,72,73,75,77,78,79,80)
九、对运发动的研究Fri等人对力量运发动停止了尝试(88)。与慰藉剂对照组比拟,利用外源性的GH的力量运发动的IGF-1程度增加了一倍,但二头肌和股四头肌向心收缩更大力量没有增加。
因而,Fri等人认为,利用外源性生长激素带来的瘦体重增加,明显不是因为收缩卵白的增加,而是因为液体滞留或结缔组织增生。
kas等人对11篇关于“GH与肌肉力量”的文献后停止了系统回忆,发现利用GH的运发动增加了瘦体重,但是肌肉力量没有增加(86)。
Hau等人对英文数据库内的27篇关于 “GH与运动才能” 的文献停止了系统回忆,得出 “GH利用者比不利用者的瘦体重均匀增加1.3-2.9KG(87),但是力量和运动才能似乎没有改善。
基于那些证据,我们认为,外源性GH可能不会增加肌纤维数量。
因为,理论上说,若是肌纤维数增加了,那肌肉力量也应该增加才对。
十、关于IGF-2它是IGF家族中一个缺乏存在感的成员,但是它跟肌纤维增生也有关。
Yuzo等人报导,在大舌症病人的舌组织上发现了明显了肌纤维数量增加(89),以及IGF-2数量增加。
有研究提出,IGF-2在生命早期(如产前)细胞增生中阐扬了重要感化(90)。IGF-2被认为在胎儿组织和癌细胞生长中阐扬了必然感化,但其感化并非出格清晰。
有些研究发现,IGF-2与体重/瘦削(91)、心血管疾病风险(92)、高血压(93,94)、高血脂(95)等疾病有关。IGF-2也能促进骨骼肌中的成肌细胞分化和肌肥大(96,97,98,99,100)。
但是,我其实不认为GM能通过IGF-2来增加纤维数,固然我们在上面提到了“成肌细胞”。
那也就是我们鄙人面马上要说的。
十一、关于成肌细胞成肌细胞是啥?
它是肌纤维细胞的前体细胞。它能够开展为 “肌管” 、再发育为 “肌纤维” 。
我们健身的,应该都传闻过肌卫星细胞:一种静行在细胞膜和肌膜上的细胞。它们能够在骨骼肌受损后被激活,“修补”破损的骨骼肌。
那在损伤修复理论中提的比力多。
其实,大大都人都容易忽略,成肌细胞就是被激活的卫星细胞(101,102,103)。
我们在上面说了,IGF-2能促进成肌细胞分化,而且似乎GH也能够。研究发现,某些成肌细胞(例如一种叫C2C12的成肌细胞)表露在GH中会产生差别强度的分子信号反响(117,118)。但仅凭那个还不克不及判定C2C12就能“增加”肌纤维数。
关于GH/IGF-2能、仍是不克不及增加肌纤维数,更多的研究认为不克不及。
Ron等人按照细胞周期理论提出,产前肌肉生长的特点才是肌纤维数增加(104)。换言之,出生后才是以体积增长为主。
其它对哺乳动物的研究表白,虽然重生大鼠、小鼠和人类婴儿的肌肉纤维数量略有增加,但总体而言,出生后肌肉纤维数量并没有显著增加(105,106,107)。
也有研究提出,出生后肌肉纤维增生的水平是出生时胚胎发育水平的函数(108,109)。
更重要的是,固然IGF-1/2都能刺激成肌细胞/卫星细胞的分化和增殖,但现有研究其实不认为它们具有发育为新的肌细胞的可能性(110,111)。
references1.J S Strobl,M J Thomas.Human growth hormone.Pharmacol Rev.1994 Mar;46(1):1-34.
2.Melmed S. Physiology of growth hormone. UpToDate. In: Rose BD, editor. UpToDate. 2008. Waltham, MA.
3.Fernando Cordido, Maria Luisa Isidro, Rosa Nemi?a, Susana Sangiao-Alvarellos.Ghrelin and growth hormone secretagogues, physiological and pharmacological aspect.Curr Drug Discov Technol. 2009 Mar;6(1):34-42.
4.Maria Luisa Isidro, Fernando Cordido,Growth hormone secretagogues.Comb Chem High Throughput Screen.2006 Mar;9(3):175-80.
5.J Herrington,Carter-Su. Signaling pathways activated by the growth hormone receptor. Trends Endocrinol Metab.2001 Aug;12(6):252-7.
6.Conway-Campbell B.L., Brooks A.J., Robinson P.J., Perani M., Waters M.J. The extracellular domain of the growth hormone receptor interacts with coactivator activator to promote cell proliferation. Mol. Endocrinol. 2008;22:2190–2202.
7.Lin S., Li H., Mu H.,Luo W.,Li Y.,Jia X.,Wang S.,Jia X.,Nie Q.,Li Y.,et al. Let-7b regulates the expression of the growth hormone receptor gene in deletion-type dwarf chickens. BMC Genom. 2012;13:306.
8.Waters M.J. The growth hormone receptor. Growth Horm.IGF Res.2016;28:6–10.
9.Martínez-Moreno C., Calderón-Vallejo D., Harvey S., Arámburo C., Quintanar J. Growth Hormone (GH) and Gonadotropin-Releasing Hormone (GnRH) in the Central Nervous System: A Potential Neurological Combinatory Therapy? Int. J. Mol. Sci. 2018;19:375.
10.Reh C.S., Geffner M.E. Somatotropin in the treatment of growth hormone deficiency and Turner syndrome in pediatric patients: A review. Clin. Pharmacol. 2010;2:111–122.
11.Soendergaard C., Young J., Kopchick J. Growth Hormone Resistance—Special Focus on Inflammatory Bowel Disease. Int. J. Mol. Sci. 2017;18:1019.
12.Adam R Nicholls, Richard I G Holt,Growth Hormone and Insulin-Like Growth Factor-1.Front Horm Res.2016;47:101-14.
13.Cesar L Boguszewski,Edna J L Barbosa,Per-Arne Svensson.MECHANISMS IN ENDOCRINOLOGY: Clinical and pharmacogenetic aspects of the growth hormone receptor polymorphism.clinical & translationalendocrinology
14.Stein A.M., Silva T.M.V., Coelho F.G.M., Arantes F.J., Costa J.L.R., Teodoro E., Santos-Galduroz R.F. Physical exercise, IGF-1 and cognition A systematic review of experimental studies in the elderly. Dement. Neuropsychol. 2018;12:114–122.
15.Majorczyk M., **olag D. Effect of physical activity on IGF-1 and IGFBP levels in the context of civilization diseases prevention. Rocz. Panstw. Zakl. Hig. 2016;67:105–111.
16.Fanyu Z, Bo Hua, Tengfei Wang, Mei Wang, Zhong Xiang Ding, Ju-Rong Ding,Abnormal amplitude of spontaneous low-frequency fluctuation in children with growth hormone deficiency: A resting-state functional magnetic resonance imaging study.Neurosci Lett.2020 Dec 5;135546.
17.Tadashi Yoshida1,Patrice Delafontaine.Mechanisms of IGF-1-Mediated Regulation of Skeletal Muscle Hypertrophy and Atrophy.Cells. 2020 Sep;9(9).
18.Marc A. Egerman and David J. Glasscorresponding author.Signaling pathways controlling skeletal muscle mass.Crit Rev Biochem Mol Biol. 2014 Jan; 49(1): 59–68.
19.David J. Glass.Skeletal muscle hypertrophy and atrophy signaling pathways.The International Journal of Biochemistry & Cell Biology 37 (2005) 1974–1984.
20.Rommel C., Bodine S.C., Clarke B.A., Rossman R., Nunez L., Stitt T.N., Yancopoulos G.D., Glass D.J. Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR and PI(3)K/Akt/GSK3 pathways. Nat. Cell Biol. 2001;3:1009–1013.
21.Peng X.D., Xu P.Z., Chen M.L., Hahn-Windgassen A., Skeen J., Jacobs J., Sundararajan D., Chen W.S., Crawford S.E., Coleman K.G., et al. Dwarfism, impaired skin development, skeletal muscle atrophy, delayed bone development, and impeded adipogenesis in mice lacking Akt1 and Akt2. Genes Dev. 2003;17:1352–1365.
22.Stefan Grüner , Daniel Peter, Ramona Weber, Lara Wohlbold, Min-Yi Chung, Oliver Weichenrieder, Eugene Valkov, Cátia Igreja, Elisa Izaurralde,The Structures of eIF4E-eIF4G Complexes Reveal an Extended Interface to Regulate Translation Initiation.Mol Cell.2016 Nov 3;64(3):467-479.
23.Gruner S., Peter D., Weber R., Wohlbold L., Chung M.Y., Weichenrieder O., Valkov E., Igreja C., Izaurralde E. The structures of eIF4E-eIF4G complexes reveal an extended interface to regulate translation initiation. Mol. Cell. 2016;64:467–479.
24.Bodine S.C., Latres E., Baumhueter S., Lai V.K., Nunez L., Clarke B.A., Poueymirou W.T., Panaro F.J., Na E., Dharmarajan K., et al. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science. 2001;294:1704–1708.
25.Pallafacchina G., Calabria E., Serrano A.L., Kalhovde J.M., Schiaffino S. A protein kinase B-dependent and rapamycin-sensitive pathway controls skeletal muscle growth but not fiber type specification. Proc. Natl. Acad. Sci. USA. 2002;99:9213–9218.
26.Glass D.J. Molecular mechanisms modulating muscle mass. Trends Mol. Med. 2003;9:344–350.
27.Desbois-Mouthon C., Cadoret A., Blivet-Van Eggelpoel M.J., Bertrand F., Cherqui G., Perret C., Capeau J. Insulin and IGF-1 stimulate the beta-catenin pathway through two signalling cascades involving GSK-3beta inhibition and Ras activation. Oncogene. 2001;20:252–259.
28.Armstrong D.D., Esser K.A. Wnt/beta-catenin signaling activates growth-control genes during overload-induced skeletal muscle hypertrophy. Am. J. Physiol. Cell Physiol. 2005;289:C853–C859.
29.Schakman O., Kalista S., Bertrand L., Lause P., Verniers J., Ketelslegers J.M., Thissen J.P. Role of Akt/GSK-3beta/beta-catenin transduction pathway in the muscle anti-atrophy action of insulin-like growth factor-I in glucocorticoid-treated rats. Endocrinology. 2008;149:3900–3908.
30.Yoon M.S. MTOR as a key regulator in maintaining skeletal muscle mass. Front. Physiol. 2017;8:788.
31.Verhees K.J., Schols A.M., Kelders M.C., Op den Kamp C.M., van der Velden J.L., Langen R.C. Glycogen synthase kinase-3beta is required for the induction of skeletal muscle atrophy. Am. J. Physiol. Cell Physiol. 2011;301:C995–C1007.
32. Pansters N.A., Schols A.M., Verhees K.J., de Theije C.C., Snepvangers F.J., Kelders M.C., Ubags N.D., Haegens A., Langen R.C. Muscle-specific GSK-3beta ablation accelerates regeneration of disuse-atrophied skeletal muscle. Biochim. Biophys. Acta. 2015;1852:490–506.
33.Verhees K.J., Pansters N.A., Baarsma H.A., Remels A.H., Haegens A., de Theije C.C., Schols A.M., Gosens R., Langen R.C. Pharmacological inhibition of GSK-3 in a guinea pig model of LPS-induced pulmonary inflammation: II. Effects on skeletal muscle atrophy. Respir. Res. 2013;14:117.
34.Schakman O., Kalista S., Bertrand L., Lause P., Verniers J., Ketelslegers J.M., Thissen J.P. Role of Akt/GSK-3beta/beta-catenin transduction pathway in the muscle anti-atrophy action of insulin-like growth factor-I in glucocorticoid-treated rats. Endocrinology. 2008;149:3900–3908.
35.O Schakman ,S Kalista,L Bertrand,P Lause,J Verniers,J M Ketelslegers,J P Thissen.Role of Akt/GSK-3beta/beta-catenin transduction pathway in the muscle anti-atrophy action of insulin-like growth factor-I in glucocorticoid-treated rats.Endocrinology.2008 Aug;149(8):3900-8.
36.S R Kimball.Eukaryotic initiation factor http://eIF2.Int J Biochem Cell Biol. 1999 Jan;31(1):25-9.
37.Bodine,S,Latres,Baumhueter,Lai,V.K.,Nunez,L.,Clarke,B.A.et al. (2001). Identification of ubiquitin ligasesrequired for skeletal muscle atrophy. Science, 294, 1704–1708.
38.Rommel, C., Bodine, S. C., Clarke, B. A., Rossman, R.,Nunez, L., Stitt, T. N., et al. (2001). Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR andPI(3)K/Akt/GSK3 pathways. Nat. Cell. Biol., 3, 109–113.
39.Coleman, M. E., DeMayo, F., Yin, K. C., Lee, H. M., Geske, R.,Montgomery, C., et al. (1995). Myogenic vector expression of insulin-like growth factor I stimulates muscle cell differentiation and myofiber hypertrophy in transgenic mice. J. Biol. Chem.270,12109–12116.
40.Musaro, A., McCullagh, K., Paul, A., Houghton, L., Dobrowolny, G.,Molinaro, M., et al. (2001). Localized Igf-1 transgene expression sustains hypertrophy and regeneration in senescent skeletal muscle.Nat.Genet.27,195–200.
41.Lai, K.-M., Gonzalez, M., Poueymirou, W. T., Kline, W. O., Na,E., Zlotchenko,et al.(2004). Conditional activation of akt in adult skeletal muscle induces rapid hypertrophy. Mol. Cell. Biol.,24, 9295–9304.
42.DeVol, D. L., Rotwein, P., Sadow, J. L., Novakofski, J., & Bechtel,P. J. (1990). Activation of insulin-like growth factor gene expression during work-induced skeletal muscle growth. Am. J.Physiol., 259, E89–E95.
43.Vandenburgh, H. H., Karlisch, P., Shansky, J., & Feldstein, R.(1991). Insulin and IGF-I induce pronounced hypertrophy of skeletal myofibers in tissue culture. Am. J. Physiol., 260, C475–C484.
44.Burnett, P. E., Barrow, R. K., Cohen, N. A., Snyder, S. H., & Sabatini,D. M. (1998). RAFT1 phosphorylation of the translational regulatorsp70 S6 kinase and 4E-BP1. Proc. Natl. Acad. Sci. U.S.A.,95, 1432–1437.
45.Pallafacchina, G., Calabria, E., Serrano, A. L., Kalhovde, J. M.,& Schiaffino, S. (2002). A protein kinase B-dependent and rapamycin- sensitive pathway controls skeletal muscle growth but not fiber type specification. Proc. Natl. Acad. Sci. U.S.A.,25.
46.Inoki, K., Li, Y., Zhu, T., Wu, J., & Guan, K. L. (2002). TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling.Nat. Cell. Biol., 4, 648–657.
47.Pullen, N., Dennis, P. B., Andjelkovic, M., Dufner, A., Kozma, S. C.,Hemmings, B. A., et al.(1998). Phosphorylation and activation of p70s6k by PDK1. Science, 279, 707–710.
48.Hannan, K. M., Thomas, G., & Pearson, R. B. (2003). Activation of S6K1 (p70 ribosomal protein S6 kinase 1) requires an initial calcium-dependent priming event involving formation of a highmolecular-mass signalling complex. Biochem. J., 370, 469–477.
49.Kubica, N., Bolster, D. R., Farrell, P. A., Kimball, S. R., & Jefferson,L. S. (2005). Resistance exercise increases muscle protein synthesis and translation of eukaryotic initiation factor 2B{epsilon} mRNA in a mammalian target of rapamycin-dependent manner.J. Biol. Chem., 280, 7570–7580.
50.Cross, D. A., Alessi, D. R., Cohen, P., Andjelkovich, M., & Hemmings,B. A. (1995). Inhibition of glycogen synthase kinase-3 by insulin mediated by protein kinase B. Nature, 378, 785–789.
51.Rommel, C., Bodine, S. C., Clarke, B. A., Rossman, R.,Nunez, L., Stitt, T. N., et al. (2001). Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR andPI(3)K/Akt/GSK3 pathways. Nat. Cell. Biol., 3, 109–113.
52.Vyas, D. R., Spangenburg, E. E., Abraha, T. W., Childs, T. E.,& Booth, F. W. (2002). GSK-3beta negatively regulates skeletal myotube hypertrophy. Am. J. Physiol. Cell. Physiol., 283,C545–C551.
53.Hardt, S. E., & Sadoshima, J. (2002). Glycogen synthase kinase3beta:A novel regulator of cardiac hypertrophy and development.Circ. Res., 90, 155–163.
54.Kawano, Y., & Kypta, R. (2003). Secreted antagonists of the Wnt signalling pathway. J. Cell. Sci., 116, 2627–2634.
55.Veeman, M. T., Axelrod, J. D., & Moon, R. T. (2003). A second canon. Functions and mechanisms of beta-catenin-independent Wnt signalling. Dev. Cell., 5, 367–377.
56.Bodine, S. C., Latres, E., Baumhueter, S., Lai, V. K., Nunez, L.,Clarke, B. A., et al. (2001). Identification of ubiquitin ligases required for skeletal muscle atrophy. Science, 294, 1704–1708.
57.Bodine, S. C., Stitt, T. N., Gonzalez, M., Kline, W. O., Stover, G.L., Bauerlein, R., et al. (2001). Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo. Nat. Cell. Biol., 3, 1014–1019.
58.Dehoux, M. J. M., van Beneden, R. P., Fernandez-Celemin, L., Lause,P. L., & Thissen, J.-P. M. (2003). Induction of MafBx and Murfubiquitin ligase mRNAs in rat skeletal muscle after LPS injection.FEBS Lett., 544, 214–217.
59.Dehoux, M. J. M., van Beneden, R. P., Fernandez-Celemin, L., Lause,P. L., & Thissen, J.-P. M. (2003). Induction of MafBx and Murf ubiquitin ligase mRNAs in rat skeletal muscle after LPS injection.FEBS Lett., 544, 214–217.
60.DeRuisseau, K. C., Kavazis, A. N., Deering, M. A., Falk, D. J.,Van Gammeren, D., Yimlamai, T., Ordway, G. A., & Powers,S. K. (2005). Mechanical ventilation induces alterations of the ubiquitin-proteasome pathway in the diaphragm. J. Appl. Physiol.,98, 1314–1321, Epub 2004 Nov 19.
61.Martin L. Adamo a, Roger P. Farrar b,Resistance training, and IGF involvementin the maintenance of muscle mass during the aging process.Ageing Research Reviews 5 (2006) 310–331
62.Cohen S, Brault JJ, Gygi SP, Glass DJ, Valenzuela DM, Gartner C, Latres E, Goldberg AL.During muscle atrophy, thick, but not thin, filament components are degraded by MuRF1-dependent ubiquitylation.J Cell Biol. 2009 Jun 15; 185(6):1083-95.
63.McPherron AC, Lawler AM, Lee SJ.Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member.Nature. 1997 May 1; 387(6628):83-90.
64.Morissette M.R., Cook S.A., Buranasombati C., Rosenberg M.A., Rosenzweig A. Myostatin inhibits IGF-I-induced myotube hypertrophy through Akt. Am. J. Physiol. Cell Physiol. 2009;297:C1124–C1132.
65.Taylor W.E., Bhasin S., Artaza J., Byhower F., Azam M., Willard D.H., Jr., Kull F.C., Jr., Gonzalez-Cadavid N. Myostatin inhibits cell proliferation and protein synthesis in C2C12 muscle cells. Am. J. Physiol. Endocrinol. Metab. 2001;280:E221–E228.
66.Trendelenburg A.U., Meyer A., Rohner D., Boyle J., Hatakeyama S., Glass D.J. Myostatin reduces Akt/TORC1/p70S6K signaling, inhibiting myoblast differentiation and myotube size. Am. J. Physiol. Cell Physiol. 2009;296:C1258–C1270.
67.Lipina C., Kendall H., McPherron A.C., Taylor P.M., Hundal H.S. Mechanisms involved in the enhancement of mammalian target of rapamycin signalling and hypertrophy in skeletal muscle of myostatin-deficient mice. FEBS Lett. 2010;584:2403–2408.
68.B?hni R, Riesgo-Escovar J, Oldham S, Brogiolo W, Stocker H, Andruss BF, Beckingham K, Autonomous control of cell and organ size by CHICO, a Drosophila homolog of vertebrate IRS1-4.Hafen E Cell. 1999 Jun 25; 97(7):865-75.
69.Haruta T, Uno T, Kawahara J, Takano A, Egawa K, Sharma PM, Olefsky JM, Kobayashi M.A rapamycin-sensitive pathway down-regulates insulin signaling via phosphorylation and proteasomal degradation of insulin receptor substrate-1.Mol Endocrinol. 2000 Jun; 14(6):783-94.
70.Lee AV, Gooch JL, Oesterreich S, Guler RL, Yee DMol Cell Biol. Insulin-like growth factor I-induced degradation of insulin receptor substrate 1 is mediated by the 26S proteasome and blocked by phosphatidylinositol 3-kinase inhibition.2000 Mar; 20(5):1489-96.
71.Tzatsos A, Kandror KVMol Cell Biol. 2006 Jan; 26(1):63-76.Nutrients suppress phosphatidylinositol 3-kinase/Akt signaling via raptor-dependent mTOR-mediated insulin receptor substrate 1 phosphorylation.
72.Xu X, Sarikas A, Dias-Santagata DC, Dolios G, Lafontant PJ, Tsai SC, Zhu W, Nakajima H, Nakajima HO, Field LJ, Wang R, Pan ZQ.The CUL7 E3 ubiquitin ligase targets insulin receptor substrate 1 for ubiquitin-dependent degradation.
73.Zhande R, Mitchell JJ, Wu J, Sun XJ.Molecular mechanism of insulin-induced degradation of insulin receptor substrate 1.
74.Florini JR, Ewton DZ, Coolican SA. Growth hormone and the insulin-like growth factor system in myogenesis. Endocr Rev. 1996;17(5):481–517
75.M De Rossi 1 , P Bernasconi, F Baggi, R de Waal Malefyt, R Mantegazza.Cytokines and chemokines are both expressed by human myoblasts: possible relevance for the immune pathogenesis of muscle http://inflammation.Int Immunol.2000 Sep;12(9):1329-35. doi: 10.1093/intimm/12.9.1329.
76.Baker J, Liu JP, Robertson EJ, Efstratiadis A. Role of insulin-like growth factors in embryonic and postnatal growth. Cell 75: 73– 82, 1993.
77.Florini JR, Ewton DZ, Coolican SA. Growth hormone and the insulin-like growth factor system in myogenesis. Endocr Rev 17:481–517, 1996.
78.Galvin CD, Hardiman O, Nolan CM. IGF-1 receptor mediates differentiation of primary cultures of mouse skeletal myoblasts. Mol Cell Endocrinol 200: 19 –29, 2003.
79.Liu JP, Baker J, Perkins AS, Robertson EJ, Efstratiadis A. Mice carrying null mutations of the genes encoding insulin-like growth factor I(Igf-1) and type 1 IGF receptor (Igf1r). Cell 75: 59 –72, 1993.
80.Powell-Braxton L, Hollingshead P, Warburton C, Dowd M, Pitt**eek S, Dalton D, Gillett N, Stewart TA. IGF-I is required for normal embryonic growth in mice. Gene Dev 7: 2609 –2617, 1993.
81.Bohni, R., Riesgo-Escovar, J., Oldham, S., Brogiolo, W., Stocker,H., Andruss, B. F., et al. (1999). Autonomous control of cell and organ size by CHICO, a Drosophila homolog of vertebrate IRS1-4. Cell, 97, 865–875.
82.Leevers, S. J., Weinkove, D., MacDougall, L. K., Hafen, E., & Waterfield,M. D. (1996). The Drosophila phosphoinositide 3-kinase Dp110 promotes cell growth. EMBO J., 15, 6584–6594.
83.Zhang, H., Stallock, J. P., Ng, J. C., Reinhard, C., & Neufeld, T.P. (2000). Regulation of cellular growth by the drosophila target of rapamycin dTOR [in process citation]. Genes Dev., 14,2712–2724.
84.Montagne, J., Stewart, M. J., Stocker, H., Hafen, E., Kozma, S. C.,& Thomas, G. (1999). Drosophila S6 kinase: A regulator of cell size [see comments]. Science, 285, 2126–2129.
85.Ohanna, M., Sobering, A. K., Lapointe, T., Lorenzo, L., Praud, C.,Petroulakis, E., et al. (2005). Atrophy of S6K1?/? skeletal musclecells reveals distinct mTOR effectors for cell cycle and size control. Nat. Cell. Biol., 7, 286.
86.Kasper Hermansen, Mads Bengtsen, Michael Kj?r, Peter Vestergaard, Jens Otto Lunde J?rgensen.Impact of GH administration on athletic performance in healthy young adults: A systematic review and meta-analysis of placebo-controlled trials.Growth Horm IGF Res.2017 Jun;34:38-44. doi: 10.1016/j.ghir.2017.05.005. Epub 2017 May 10.
87.Hau Liu 1 , Dena M Bravata, Ingram Olkin, Anne Friedlander, Vincent Liu, Brian Roberts, Eran Bendavid, Olga Saynina,Shelley R Salpeter, Alan M Garber, Andrew R Hoffman.Systematic review: the effects of growth hormone on athletic performance.Ann Intern Med.2008 May 20;148(10):747-58.
88.H Frisch.Growth hormone and body composition in athletes.J Endocrinol Invest. 1999;22(5 Suppl):106-9.
89.Yuzo Oyama, Haruto Nishida,corresponding author Osamu Kobayashi, Kenji Kawano, Kenji Ihara, and Tsutomu Daa.Macroglossia in Beckwith-Wiedemann Syndrome Is Attributed to Skeletal Muscle Hyperplasia.Case Rep Dent. 2020; 2020: 8871961.
90.Cianfarani S. Insulin-like growth factor-II: new roles for an old actor. Frontiers in Endocrinology. 2012;3:p. 118.
91.Cooper JA, Hindmarsh PC, Pringle PJ, Ford H, Humphries SE.Apal polymorphism in insulin-like growth factor II (IGF2) gene and weight in middle-aged males. ODell SD, Miller GJ, Day IN Int J Obes Relat Metab Disord. 1997 Sep; 21(9):822-5.
92.A Rice T, Chagnon YC, Pérusse L, Borecki IB, Ukkola O, Rankinen T, Gagnon J, Leon AS, Skinner JS, Wilmore JH, Bouchard C, Rao DC.genomewide linkage scan for abdominal subcutaneous and visceral fat in black and white families: The HERITAGE Family Study.Diabetes. 2002 Mar; 51(3):848-55.
93.Rodríguez S, Gaunt TR, ODell SD, Chen XH, Gu D, Hawe E, Miller GJ.Haplotypic analyses of the IGF2-INS-TH gene cluster in relation to cardiovascular risk traits.Humphries SE, Day IN Hum Mol Genet. 2004 Apr 1; 13(7):715-25.
94.Faienza MF, Santoro N, Lauciello R, Calabrò R, Giordani L, Di Salvo G, Ventura A, Delvecchio M, Perrone L, Del Giudice EM, Cavallo L.IGF2 gene variants and risk of hypertension in obese children and adolescents.Pediatr Res. 2010 Apr; 67(4):340-4
95.Kadlecová M, Dobesová Z, Zicha J, Kunes JAbnormal Igf2 gene in Prague hereditary hypertriglyceridemic rats: its relation to blood pressure and plasma lipids.Mol Cell Biochem. 2008 Jul; 314(1-2):37-43.
96.Florini JR, Magri KA, Ewton DZ, James PL, Grindstaff K, Rotwein PS."Spontaneous" differentiation of skeletal myoblasts is dependent upon autocrine secretion of insulin-like growth factor-II.J Biol Chem. 1991 Aug 25; 266(24):15917-23.
97.Stewart CE, Rotwein P.Insulin-like growth factor-II is an autocrine survival factor for differentiating myoblasts.J Biol Chem. 1996 May 10; 271(19):11330-8.
98.Stewart CE, James PL, Fant ME, Rotwein P.Overexpression of insulin-like growth factor-II induces accelerated myoblast differentiation.J Cell Physiol. 1996 Oct; 169(1):23-32.
99.Van Laere AS, Nguyen M, Braunschweig M, Nezer C, Collette C, Moreau L, Archibald AL, Haley CS, Buys N, Tally M, Andersson G, Georges M, Andersson L.A regulatory mutation in IGF2 causes a major QTL effect on muscle growth in the pig.Nature. 2003 Oct 23; 425(6960):832-6.
100.Alzhanov DT, McInerney SF, Rotwein P.Long range interactions regulate Igf2 gene transcription during skeletal muscle differentiation.J Biol Chem. 2010 Dec 10; 285(50):38969-77.
101.Fyfe I, Stranish WD. The use of eccentric mining and stretchingin the treatment and prevention of tendon injuries[J].Clin Sports Med, 2001,11 (3):601—624.
102.Kurek JB, Nouri Sara, Kannourakis George. Leukemia Inhibitory factor and interleukin-6 are produced by diseased and regenerating skeletal muscle[J]. Muscle & Nerve, 2002, 19:1291—1301.
103.Faulkner JA, Kelly AM,Bischoff R. Proliferation of muscle satellite cells on intact myofiber in culture [J]. Dev Biol,2003,68:109-136.
104.Ronald E. AUen, Robert A. Merkel ,and Ronald B. Young TM.CELLULAR ASPECTS OF MUSCLE GROWTH:MYOGENIC CELL PROLIFERATION.Micbigan State University East Lansing 48824.
105.Chiakulas, J. J. and J. E. Pauly. 1965. A study of postnatal growth of skeletal muscle in the rat.Anat. Rec. 152:55.
106.Goldspink, G. 1962. Studies on postembryonic growth and development of skeletal muscle. Proc. Roy.Irish Acad. 62:135.
107.Montgomery, R. D. 1962. Growth of human straited muscle. Nature 195:194.
108.Goldspink, G. 1972. Postembryonic growth and differentiation of striated muscle. In G. H.Bourne (Ed.) The Structure and Function of Muscle. Vol. 1, 2nd Ed. p. 179. Academic Press,Inc., New York.
109.Swatland, H. J. 1976. Recent research on postnatal muscle development in swine. Proc. Recip. Meat Conf. 29:86.
110.Boonen KJ, Post MJ. The muscle stem cell niche: regulation of satellite cells during regeneration. Tissue Eng B Rev. 2008;14(4):419–431.
111.Machida S, Spangenburg EE, Booth FW. Primary rat muscle progenitor cells have decreased proliferation and myotube formation during passages
112.C L Sadowski , T T Wheeler, L H Wang, H B Sadowski.GH regulation of IGF-I and suppressor of cytokine signaling gene expression in C2C12 skeletal muscle cells.Endocrinology.2001 Sep;142(9):3890-900.
113.Charles H Lang 1 , Ly Hong-Brown, Robert A Frost.Cytokine inhibition of JAK-STAT signaling: a new mechanism of growth hormone resistance.Pediatr Nephrol.2005 Mar;20(3):306-12.
114.L S Argetsinger , G S Campbell, X Yang, B A Witthuhn, O Silvennoinen, J N Ihle, C Carter-Su.Identification of JAK2 as a growth hormone receptor-associated tyrosine kinase.Cell.1993 Jul 30;74(2):237-44.
115.J Isgaard , A Nilsson, K Vikman, O G Isaksson.Growth hormone regulates the level of insulin-like growth factor-I mRNA in rat skeletal muscle.J Endocrinol. 1989 Jan;120(1):107-12.
116.Gosteli-Peter M, Winterhalter K, Schmid C, Froesch E, Zapf J 1994 Expression and regulation of insulin-like growth factor-I (IGF-I) and IGF-binding protein messenger ribonucleic acid levels in tissues of hypophysectomized rats infused with IGF-I and growth hormone. Endocrinology 136:2558–2567
117.Cynthia L. Sadowski, Thomas T. Wheeler, Lu-Hai Wang, Henry B. Sadowski.GH Regulation of IGF-I and Suppressor of Cytokine Signaling Gene Expression in C2C12 Skeletal Muscle Cells.Endocrinology, Volume 142, Issue 9, 1 September 2001.
118.Ivan Dimauro 1 , Fiorenza Magi, Gina La Sala, Monica Pittaluga, Paolo Parisi, Daniela Caporossi.Modulation of the apoptotic pathway in skeletal muscle models: the role of growth hormone.Growth Factors.2011 Feb;29(1):21-35.
版权声明
本文仅代表作者观点,不代表木答案立场。


